天は自ら助くる者を助く (Heaven helps those who help themselves)
長田裕之 (静岡県立大学薬学部、理化学研究所環境資源科学研究センター)
はじめに
私は、中学生の時に岩波新書で「世界の酒」(著者は東京大学名誉教授で農芸化学者の坂口謹一郎先生)を読み、世界中の銘醸地を巡って美味い酒と料理を堪能できる著者を羨ましく思った。私が1976年に東大の農芸化学科に進学したのは、「美味い酒」という下心がなかったとは言わないが、分子生物学の研究ができる学科だからだ。当時は、日本分子生物学会が発足する前だったが、駒場(教養課程)で受けた講義では、分子生物学の新鮮な息吹を感じた。お酒の神様・坂口謹一郎先生はすでに定年退職していたが、その後を継いだ有馬啓先生の研究室は、日本で最も早く分子生物学の研究を始めた研究室の一つだった。1977年に卒論研究のために、かつて坂口先生が主宰していた発酵学研究室に入ることができた。私の指導教官は、有馬啓先生の後を受けて教授になられた別府輝彦先生で、「コリシン(colicin) E2 の作用機作研究」という研究テーマを頂いた。当時は、大腸菌に感染して増殖するバクテリオファージの研究は分子生物学のモデル系として重要な課題であった。また、ある種の大腸菌は自分と近縁の細菌を殺すためにコリシンを生産するが、自分で生産するコリシンでは死なないことが謎だった。
コリシンE2の作用機作研究
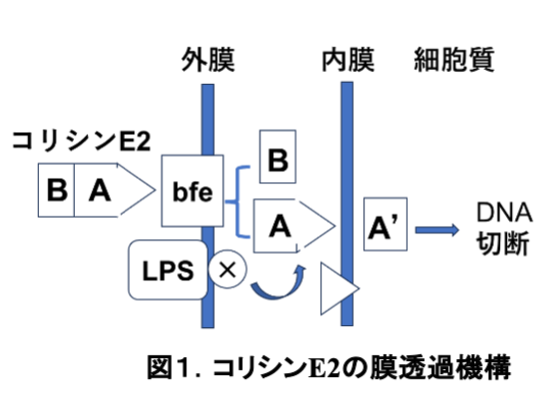
分子量約6万のタンパク質であるコリシンE2 は、活性本体のAサブユニットと生産菌が自殺しないように保護するBサブユニットから成る。コリシンE2は、近縁の細菌(大腸菌や赤痢菌)の外膜に存在する受容体タンパク質 bfe に結合した後、活性サブユニットのAが細胞内に入って DNA を切断することが知られていた。私は卒論研究に続いて博士課程でもコリシンE2 の作用機作研究を継続し、 リポ多糖で活性化されるプロテアーゼX の存在を明らかにし、サブユニットAは、プロテアーゼXで切断されて活性型になり、DNAを切断することを明らかにした(1) (図1)。
博士課程の最終年度になった時、別府先生から、「理化学研究所の磯野清先生(抗生物質研究室主任研究員)が研究員を募集しているので、会いに行きなさい。」と言われた。子供の頃に物理学者になって理研で研究したいと思っていたが、農芸化学に進学した時には理研で研究することはないと思っていた。迂闊にも、坂口謹一郎先生が東大を定年退職された後に理研の副理事長になっていたことも知らなかった。もし、理研で研究できる機会があるなら、こんなに嬉しい話はないと思い、早速、別府先生から磯野先生に電話して頂いた。
Ascamycinとの出会い
1982年の5月頃だったか、和光市駅に初めて降り立ち、磯野先生の研究室を訪れた。その時に、いろんな話をしたが、「別府先生の研究グループがAT-265と言う抗生物質を単離したが、私たちもそれに似た抗生物質を単離したのです。」と磯野先生が話された。
私は磯野先生に、当時の別府研で行っていた抗生物質研究についてお話しした。企業から研究生として派遣されていた高橋栄作さんが、グラム陰性細菌に効く抗生物質が少なかったので、グラム陰性細菌に有効な抗生物質を狙ったスクリーニング系でヌクレオシド系抗生物質AT-265が見出されたことを説明した。
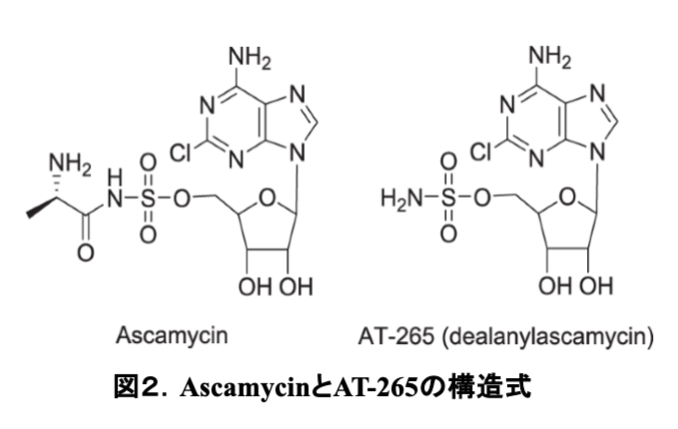
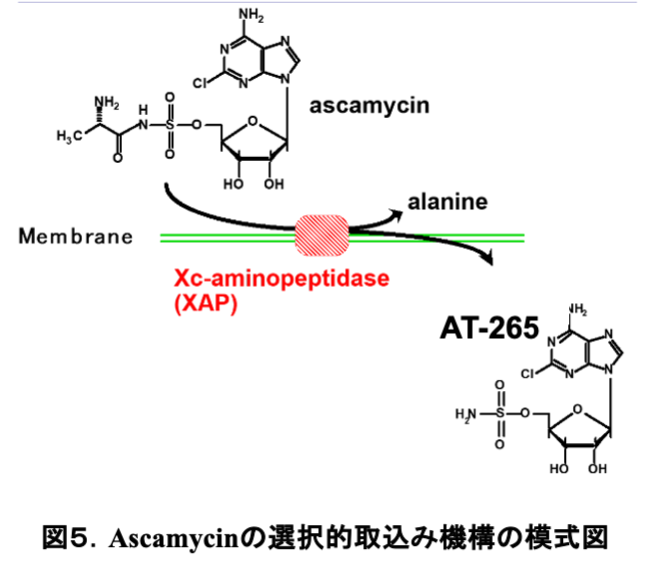
磯野先生からは、植物病原菌に防除効果のある抗生物質を探索した結果、AT-265 にアラニンが付加した新規抗生物質ascamycinを単離した経緯をお聞きした。AT-265 とascamycinの化学構造(図2)の違いは, アラニンの有無だけなのだが、生物活性は大きく異なっており、AT-265はグラム陰性菌を中心に広範囲の細菌類に抗菌活性を示すのに対して、ascamycinは植物病原菌キサントモナス(Xanthomonas)菌にしか抗菌活性を示さないとお聞きした瞬間、私の頭の中には一つのストーリー(作業仮説)が浮かんだ。私が博士論文研究で行ったコリシン E2 の作用機作研究から、ascamycinが効くキサントモナス菌の細胞表層に固有のアミノペプチダーゼがあるのではないかと閃いたのだ。磯野先生に、「理研に採用して頂けるなら、ぜひascamycinの作用機作研究をさせて下さい。」とお願いした。この時点では、ascamycinもAT-265もまだ論文として公開されていなかったし、その抗菌スペクトルの違いを知っているのは、世界中で自分だけだと思うと、一刻も早く、作業仮説を証明するための実験に取り掛かりたいとワクワクした。
今も同じかどうか知らないが、当時の東大農芸化学の教授陣は、学位を出すか否かは自分たちで判断するという矜持を持っており、学術誌に掲載された論文がなくても博士号を出していた。勿論、実験をしながら学術誌にも論文を発表する優秀な学生もいたが、多くの学生は実験に明け暮れて、ようやく博士課程の終了間際になって論文を投稿するので、博士課程終了時に論文掲載が間に合わない例も多かった。今の理研では、論文ゼロで研究員に採用されることはないと思うが、私は論文ゼロで学位(農学博士)を頂き、1983年4月に理化学研究所の抗生物質研究室に入れて頂いた。
Ascamycinの選択毒性機構
磯野先生からは、業務として「抗生物質の生産菌を分子生物学的手法で育種して、抗生物質の生産性を上げること」を命じられたが、ascamycinの作用機作研究をすることも許可されたので実験を開始した。
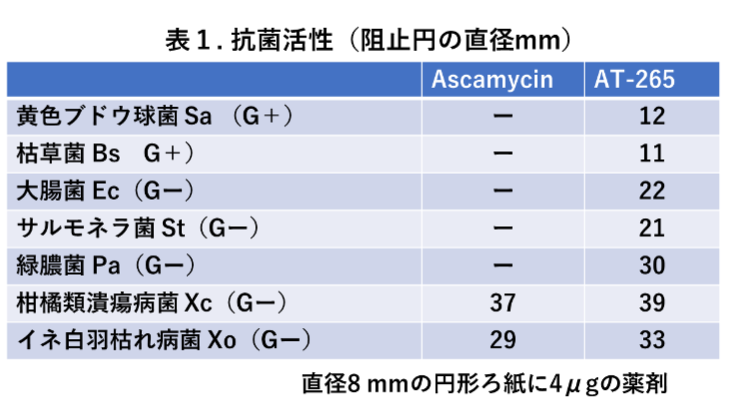
Ascamycinの生産菌は、ascamycinとAT-265の両方を生産したので、両方の化合物を単離し、自分の手で両化合物の抗菌スペクトルを測定した。表1に示す通りグラム陽性菌(黄色ブドウ球菌Sa、枯草菌Bs)とグラム陰性菌(大腸菌Ec、サルモネラ菌St、緑膿菌Pa、柑橘類潰瘍病菌菌Xc、イネ白葉枯れ病菌Xo)を寒天平板に重層し、ascamycinとAT-265を4 µg浸み込ませた円形ろ紙をその上に置いた。抗菌活性の強さは、ろ紙の周辺にできた阻止円の直径を測定することで評価した。AT-265は論文発表の通り、グラム陰性菌に強い抗菌活性を示し、グラム陽性菌にも効いた。一方、ascamycinは植物病原菌のキサントモナス菌(Xc, Xo)には強い抗菌活性を示したが、それ以外の菌には全く効かなかった。
グラム陽性菌とグラム陰性菌の大きな違いは、細胞壁構造の違いにあり、グラム陽性菌の外側には厚いペプチドグリカン層が存在し、グラム陰性菌の外側は、リポ多糖(LPS)が存在する。リン脂質から成る細胞膜には、膜タンパク質が存在し、分子量や三次元構造の違いで固有のタンパク質孔(ポア)、キャリア、受容体として機能し、物質の選択的な取り込みを行うLPSは脂溶性物質の透過障壁となっている。
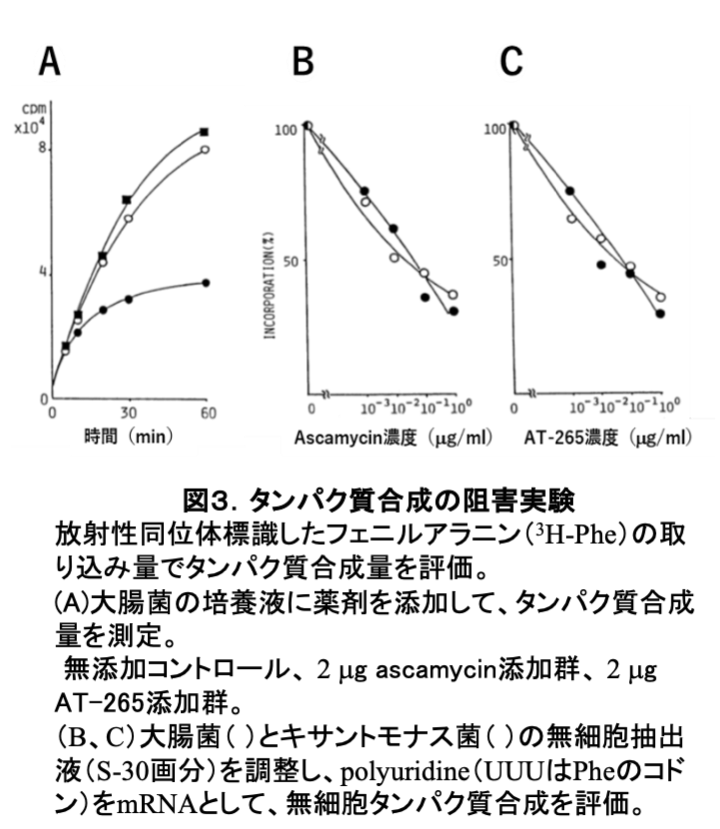
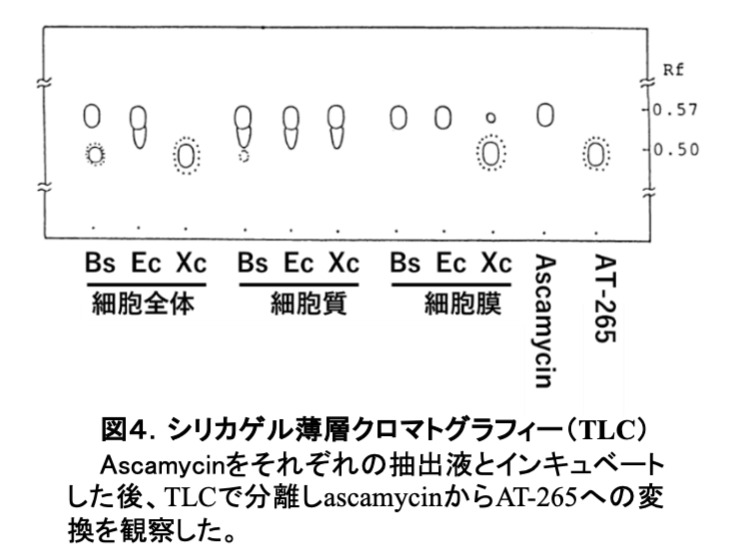
アミノ酸あるいはヌクレオシドの単体であれば膜を透過できるが、その融合化合物であるascamycinは膜を透過できないと思われた。それを証明するために大腸菌にascamycinとAT-265を添加して、タンパク質合成を阻害するか否かを確認した。図3Aに示す通り、AT-265はタンパク質合成を阻害したが、ascamycinは阻害しなかった。さらに、大腸菌(図3B)とキサントモナス菌(図3C)の細胞抽出液にmRNA(PolyU)と放射性同位体標識したフェニルアラニン(3H-Phe)を添加した無細胞実験を行った。予想通りascamycinはAT-265と同様に大腸菌のタンパク質合成を阻害した。この結果は、キサントモナス菌の細胞表層には新規なアミノペプチダーゼが存在しており、アラニンを切断して細菌の細胞膜を容易に透過するAT-265 に変換することを示唆していた。次に、大腸菌とキサントモナス菌の無細胞抽出液を、細胞質と細胞膜に分けて、ascamycinとインキュベートした後、シリカゲル薄層クロマトグラフィー(TLC) で、ascamycinからAT-265への変換を観察した(図4)。キサントモナス菌(Xc)の細胞膜成分には、ascamycinをAT-265に変換するアミノペプチダーゼが存在するが、枯草菌(Bs)、大腸菌(Ec)の抽出物にはその活性はなかった。
すなわち、キサントモナス菌の細胞表層にはアミノアシルヌクレオシドを加水分解できる酵素が新在するので、ascamycinに感受性であるが、調べた限り、他の菌にはその酵素がないためascamycinに耐性であった。コリシンE2が膜を透過する際に、プロテアーゼで活性化されるのと同様に、ascamycinもアミノペプチダーゼで活性化されたのだ(図5)。
実験を初めてから1年も経たずに、この結果を論文にまとめて米国微生物学会誌のAntimicrob Agents Chemotherに投稿した。雑誌に掲載されたのは、博士論文で行った研究成果をまとめた論文より先だったので、実質的には、私にとってこれが最初の論文となった(2)。大学院時代に投稿論文ゼロだったので、少なからず劣等感もあったし、それでも採用してくれた磯野先生に恩返ししなければならないと思っていたので少し安堵した。
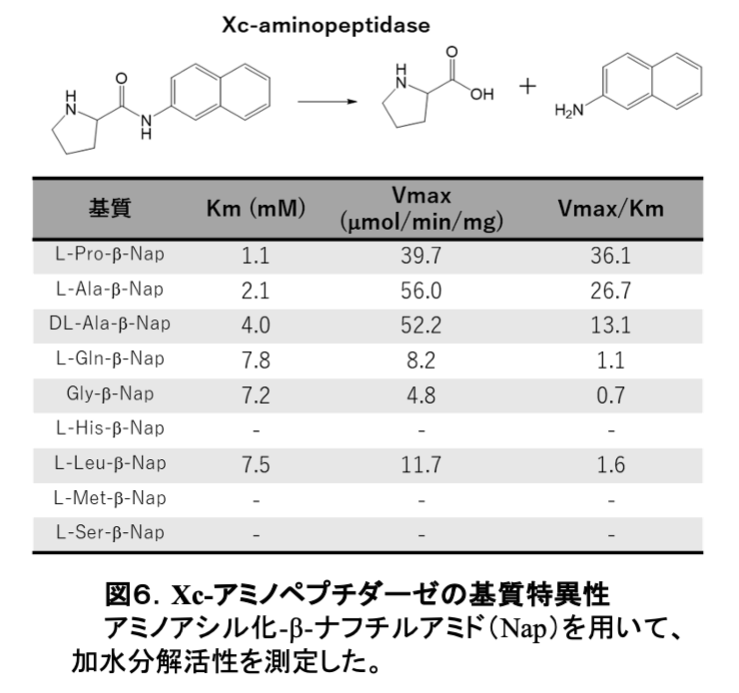
これに引き続き、キサントモナス菌を30 Lジャーで培養し、その菌体からアミノペプチダーゼの精製に取り掛かった。このタンパク質精製に関する実験も、博士論文のために大腸菌から未知のプロテアーゼXを精製した経験がものを言った。デオキシコール酸を含む緩衝液で処理して、膜表層のタンパク質だけ集め、カラムクロマトグラフィーによって、分子量38,000、等電点5.7の新規アミノペプチダーゼ(Xc-アミノペプチダーゼ)を短期間で精製することに成功した(3)。アミノ酸の特異性を調べてみると、アラニンよりプロリンの方が切れ易く、酵素の分類としては、プロリンイミノペプチダーゼであることが明らかになった。実際に、同僚の生方信博士が、様々なアミノ酸をAT-265に付けた誘導体を合成したが、やはり、プロリン誘導体がキサントモナス菌に対して最も強い抗菌活性を示した(4)。
当初、ascamycinは特定の細菌にしか効かないと思っていたが、動物細胞にも増殖阻害活性があることを見出した。初めての実験だったが、ウサギにXc-アミノペプチダーゼとアジュバントを注射してXc-アミノペプチダーゼ抗体を作製した。動物細胞の抗原量(タンパク質量)を測定したところ、多くのがん細胞にXc-アミノペプチダーゼ様の酵素が多く存在しており、ascamycinにも高い感受性を示すことが明らかになった(5)。
その後、私は米国立癌研究所で新しい増殖因子に関する研究に従事するため渡米したので、ascamycinの研究は一旦終了した。米国で行った増殖因子の発見と精製は、分泌されるタンパク質が微量だったので精製の難易度は高かったが、これまでの経験を活かしてほぼ1年で新規増殖因子Keratinocyte Growth Factor (KGF) の単離に成功した(6)。その後、KGFは脾臓からも単離され(7)、現在ではFibroblast Growth Factorファミリーに分類されFGF7/KGFと呼ばれている。
私は、1992年に理研の抗生物質研究室の主宰者(主任研究員)となり、最初に採用した研究員(須藤龍彦博士)にXc-アミノペプチダーゼのクローニングを課題として与えた。紙面の都合上、詳細は省くが、私が精製したタンパク質のN-末端アミノ酸配列を手掛かりに、目的遺伝子をクローニングすることができた(8)。その遺伝子配列に相同性を持つ遺伝子を探索したところ、淋菌(ナイセリア菌)に類似の配列が見出された。もし、淋菌の遺伝子産物が細菌表層に存在するなら、ascamycinに感受性を示すはずで、細菌薬剤耐性が問題となっている淋病治療に役立つのではないかと期待して実験を行った。しかし、ナイセリア菌のアミノペプチダーゼは菌体内酵素だったらしく、ascamycinは効かなかった。
おわりに
磯野先生と初めてお会いした時に、ascamycinを紹介して頂いたのは、私にとっては感動的な出会いだった。運命的と言っても良い。学生時代は、論文も書かずにがむしゃらに実験をしていたので、理研入所時には論文ゼロの劣等生だった。しかし、コリシンE2の作用機作研究を通して多くの経験をさせてもらい、ascamycinに出会うことができてその経験が大いに役立ったことは幸運だった。
理研の研究員として採用された時に、磯野先生から「大学では先生と生徒という師弟関係があるけど、理研では、研究者は皆平等です。僕も、君を科学者として対等だと思って接しますから、君もそうして下さい。」と言われたことは忘れられない。
(有機合成化学、81巻、2023年 「感動の瞬間」より)
文献
1) Osada H, Beppu T.: Lipopolysaccharide defective mutant of Escherichia coli with decreased sensitivity to colicin E2. Agric Biol Chem, 49: 1813-1819 (1985).
2) Osada H, Isono K.: Mechanism of action and selective toxicity of ascamycin, a nucleoside antibiotic. Antimicrob Agents Chemother, 27(2): 230-233 (1985)
3) Osada H, Isono K.: Purification and characterization of ascamycin-hydrolysing aminopeptidase from Xanthomonas citri. Biochem J, 233(2): 459-463 (1986)
4) Ubukata M, Osada H, Magae J, Isono K.: Synthesis and biological activity of aminoacyl analogs of ascamycin. Agric Biol Chem, 52: 1117-1122 (1988)
5) Osada H, Isono K.: Occurrence of an ascamycin dealanylating enzyme, Xc-aminopeptidase, in mammalian cell membranes and susceptibility to ascamycin. J Antibiot, 39(2): 286-293 (1986)
6) Rubin JS, Osada H, Finch PW, Taylor WG, Rudikoff S, Aaronson SA.: Purification and characterization of a newly identified growth factor specific for epithelial cells. Proc Natl Acad Sci U S A, 86(3): 802-806 (1989)
7) Suzuki M, Itoh T, Osada H, Rubin JS, Aaronson SA, Suzuki T, Koga N, Saito T, Mitsui Y.: Spleen-derived growth factor, SDGF-3, is identified as keratinocyte growth factor (KGF). FEBS Lett, 328(1-2): 17-20 (1993)
8) Sudo T, Shinohara K, Dohmae N, Takio K, Usami R, Horikoshi K, Osada H.: Isolation and characterization of the gene encoding an aminopeptidase involved in the selective toxicity of ascamycin toward Xanthomonas campestris pv. citri. Biochem J, 319(1): 99-102 (1996)